Comité Institucional de Ética en Investigación (CIEI) – Humanos
El CIEI – Humanos es un comité autónomo establecido por la Universidad Peruana Cayetano Heredia. Está conformado por un equipo multidisciplinario de profesionales altamente calificados y de reconocidos miembros de la sociedad.
Nosotros
Objetivo
Proteger los derechos, el bienestar y la seguridad de los participantes en investigación. El CIEI asegura el cumplimento de las responsabilidades éticas y de las regulaciones nacionales e internacionales en relación a la investigación con personas.
El funcionamiento del CIEI se basa en leyes, normas, regulaciones, códigos y otros documentos nacionales e internacionales aplicables a la investigación con personas.
Registro Internacional
El CIEI está registrado en la Office for Human Research Protections – OHRP con códigos, institucional y del CIE IORG0000671 y IRB00001014, respectivamente. Vigencia hasta el 16/05/2028.
Tiene el código de garantía federal (Federalwide Assurance) FWA00000525 con vigencia hasta el 23/01/2028.
Registro Nacional
Acreditado por el Instituto Nacional de Salud del Perú en el año 2018, con vigencia indefinida.
Historia
El Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia inició oficialmente sus actividades el 15 de junio de 1992. La presidencia del primer comité estuvo a cargo de la Dra. Graciela Risco de Domínguez, Vice Rectora Académica de la UPCH. Los miembros de este primer comité, destacados profesores de la Cayetano y miembros de la sociedad civil, fueron: el Dr. Alejandro Llanos Cuentas (Jefe de la Oficina de Investigación Científica); el Dr. Javier Cieza Zevallos; el Dr. Humberto Guerra Allison; y el MSc Jorge Arévalo; y como miembros externos la Dra. Graciela Fernández Baca; la Sra. Adela Gastañeta de Piñeiro; el Dr. Enrique Becerra Palomino; el Dr. Manuel Vegas y el Sacerdote Pedro Vega Centeno.


Miembros
Lista actualizada de miembros
Ensayos Clínicos
En el segundo semestre de 2022 se ha recibido 01 Ensayo Clínico para evaluación y a la fecha tenemos 03 ensayos clínicos vigentes.
Formatos
En el siguiente listado encontrará las instrucciones y todos los documentos necesarios para el proceso de registro y revisión de un proyecto nuevo de investigación, así como para los otros procesos que se pueden presentar durante la ejecución de la investigación.
Asimismo, la ORVEI ofrece capacitaciones y un autoinstructivo detallado de cómo llenar los diferentes formatos o documentos para el registro de un proyecto de investigación. En este enlace podrá inscribirse en las capacitaciones o revisar el autoinstructivo. (https://investigacion.cayetano.edu.pe/registro/registroenorvei)
Políticas, regulaciones y procedimientos
Los siguientes documentos de la UPCH tienen relación con las políticas, regulaciones y procedimientos sobre la investigación y la protección de las personas en investigación.
A partir del 01 de enero del 2024 todo estudiante, profesor y/o investigador de la Cayetano deberá de forma obligatoria acreditar capacitación básica de ética en investigación
Cronograma de reuniones
Las sesiones del Comité Institucional de Ética en Investigación (CIEI) se realizan todos los martes. Los proyectos se revisan en las sesiones del CIEI de acuerdo con el orden de ingreso, tipo de proyecto y volumen presentado. En este enlace se detallan las fechas de sesión del comité y las fechas límites de presentación para el periodo 2026.
NOTA IMPORTANTE
La fecha límite de presentación es la fecha en la que los documentos completos del proyecto deben ser presentados al CIEI para que potencialmente puedan ser incluidos en la agenda de la sesión del CIEI más próxima.
Tener en consideración que el número de proyectos nuevos a revisar por sesión es hasta de un máximo de 6. La fecha en la que se agenden los proyectos varía dependiendo del orden de ingreso, tipo y complejidad del proyecto y volumen presentado. Recomendamos tomar en cuenta los tiempos señalados y presentar su proyecto con la debida anticipación.
Las fechas de sesión pueden variar en adecuación a disposiciones sobre días laborables, institucionales o gubernamentales.
*En esta sesión no se revisarán proyectos nuevos; solo se revisarán otros documentos (renovaciones, informes, etc).
Servicios a terceros
Proyectos No Institucionales (NO-UPCH)
Para proyectos no institucionales (Ej. Industria farmacéutica, universidades, ONG´s, instituciones privadas o públicas, etc.) los investigadores deberán presentar los siguientes documentos de forma electrónica al correo duari.orvei@oficinas-upch.pe .
Requisitos:
- Formato F1 (NO-UPCH) para proyectos que involucran humanos, correctamente llenado y firmado*. [Formato ]
- Proyecto de investigación, instrumentos (Ej.: cuestionarios, fichas de recolección de datos, guías, etc.) Preferentemente especifique la fecha y la versión en el proyecto y en cada instrumento.
- Formatos de consentimientos (Ej.: consentimiento informado, asentimiento, etc). Todos los documentos deben cumplir con los requisitos del formato de consentimiento informado [formato ]. Los consentimientos deben ser enviados en un archivo independiente al proyecto y en formato Word, preferentemente especificando la fecha y la versión.
- Currículum Vitae actualizado de todos los investigadores principales y asesores. [modelo de CV ]
- Constancia, certificado u otro documento que acredite capacitación en ética de la investigación (Certificado del CITI Program u otro equivalente) de todos los investigadores.
- Resumen español del proyecto, en caso de que el proyecto sea presentado en inglés.
Comprobante de pago por derecho de evaluación (factura, boleta o voucher electrónico).
Ensayos Clínicos No Institucionales (NO-UPCH)
- Formato EC – NO UPCH para ensayos clínicos que involucren humanos, correctamente llenado y firmado* [Formato ]
- Proyecto de investigación, en versión en español y en idioma original si es diferente al español según el Anexo 1 del Reglamento de Ensayos Clínicos (http://bvs.minsa.gob.pe/local/MINSA/1284_INS80.pdf )
- Los instrumentos** (ej.: cuestionarios, fichas de recolección de datos, guías, materiales de reclutamiento, publicidad, etc.). Todos los documentos deben ser presentados en formato electrónico y preferentemente numerados y rotulados indicando el número de versión y fecha.
- Formatos de consentimientos** (ej.: consentimiento informado, asentimiento, etc.). Todos los documentos deben cumplir con los requisitos del formato de consentimiento informado [formato ], así como los ítems mencionados en la guía de elaboración de formato de consentimiento informado de un ensayo clínico [formato ]. Los consentimientos deben ser enviados en un archivo independiente al proyecto y en formato Word, preferentemente numerados y rotulados indicando el número de versión y fecha.
- Currículum Vítae actualizado, no documentado de todo el equipo de investigación de cada centro de investigación según lo estipulado en el Reglamento de Ensayos Clínicos (https://ensayosclinicos-repec.ins.gob.pe/images/contenido/Nuevos_formularios/2020/031Ed03-c.pdf ).
- Constancia, certificado u otro documento vigente que acredite capacitación en Buenas Prácticas Clínicas y certificado de capacitación en ética de la investigación (Certificado del CITI Program en investigación con seres humanos u otro equivalente) de todo el equipo de investigación.
- Manual del Investigador o ficha técnica del producto.
- Póliza de seguro vigente en español.
- Comprobante de pago por derecho de evaluación (factura, boleta o voucher electrónico).
* Todos los documentos que requieran firmas deben contar con firmas electrónicas, o digitalizadas, o el envío de la hoja firmada completamente escaneada. No se aceptarán documentos con firmas cortadas y pegadas de otros documentos.
** En caso aplique a su proyecto
Nota importante
Para facilitar el proceso de revisión de su proyecto de investigación le solicitamos verificar si cuenta con la información requerida. Los proyectos que no cuenten con todos los documentos, según sea el caso, no serán programados para su revisión en las sesiones del comité de ética. Todas las páginas del proyecto y de los consentimientos informados (en los casos necesarios) deberán estar claramente numeradas y con el número de versión y fecha que le corresponda.
Finalmente, la ORVEI ofrece capacitaciones y un autoinstructivo detallado de cómo llenar los diferentes formatos o documentos para el registro de un proyecto de investigación. En este enlace podrá inscribirse en las capacitaciones o revisar el autoinstructivo (considerar que algunas indicaciones van dirigidas a los proyectos institucionales): https://investigacion.cayetano.edu.pe/registro/registroenorvei
Formas de pago
A través de la Tienda Virtual UPCH (pago en línea):
Descarga el instructivo
Link para acceder al pago online: https://tiendaupch.pe/
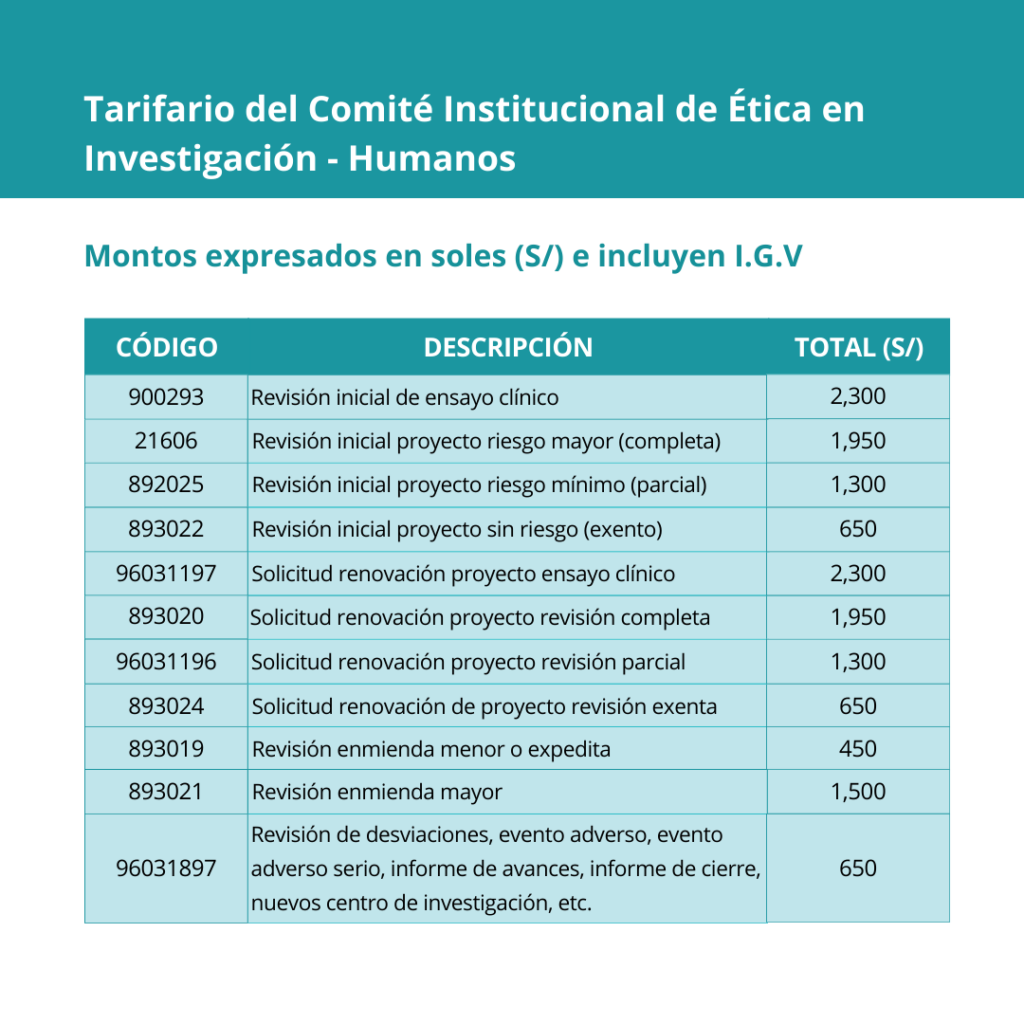
Nota: Se deberá abonar S/. 450 adicionales por cada centro de Investigación o Investigador Principal extra.
Ejm: Por la revisión de dos centros, se deberá abonar S/. 2750 (S/. 2300 por revisión + S/. 450 por el centro adicional).
Preguntas Frecuentes
Todos los proyectos de investigación que se generen en la Universidad Peruana Cayetano Heredia deberán ser registrados en la Dirección Universitaria de Asuntos Regulatorios en Investigación (DUARI).
Las unidades de gestión son las distintas facultades, centros e institutos de la UPCH.
Son los lugares en donde se llevará a cabo el proyecto. Un proyecto puede tener múltiples unidades operativas y cada una de ellas debe asumir el compromiso de apoyar la ejecución del proyecto en sus instalaciones. Estos lugares pueden estar dentro y/o fuera de la UPCH. Dentro de la UPCH se consideran los laboratorios (ej.: laboratorio de parasitología, laboratorio de malaria, laboratorio de fisiología comparada, etc.); y centros de atención de salud adscritos a UPCH (ej.: CREO, clínica dental-docente, etc.). Fuera de la UPCH se consideran las otras instituciones. Ej.: hospitales, centros de salud, institutos, colegios, ONG’s, comunidades, etc. Para el caso de los proyectos en donde no exista una unidad operativa física (ej.: revisiones sistemáticas), la firma de la unidad operativa debe ser otorgada por la unidad de investigación de la facultad, centro o instituto que respalda el proyecto.
Cuando los sujetos de investigación estén conformados por miembros de la comunidad herediana (alumnos, docentes o no-docentes de la universidad), la unidad operativa será el Vicerrectorado de Investigación.
Si no está seguro de que su proyecto necesita revisión ética, puede registrar su proyecto en la DUARI. Allí se clasificará y se le indicará por cual comité de ética deberá pasar revisión. Este proceso puede demorar un poco más, así que revise bien las fechas de las reuniones de los comités.
Para presentar tus documentos a la DUARI y que sean revisados por el CIEI, debes enviar al correo de ORVEI (duari.orvei@oficinas-upch.pe ) los siguientes documentos:
- Formato F1 o EC (según corresponda) descargable de la plataforma SIDISI una vez que la unidad de gestión haya aceptado tu proyecto en la plataforma. Debes completar la información pendiente en el formato.
- Proyecto de investigación, instrumentos y consentimientos si aplica.
- CV’s de investigadores principales y de asesor.
– Certificado de capacitación ética de acuerdo a las indicaciones del video en el siguiente link: https://investigacion.cayetano.edu.pe/cri/entrenamiento o cualquier otro equivalente.
Los estudios son aprobados por un período de 12 meses. Debe solicitarse la renovación antes del vencimiento del plazo de aprobación.
Consultas y/o quejas
Enlaces de Interés
Contacto
orvei.ciei@oficinas-upch.pe
(511) 3190000 – Anexo 201355
