Estudio clínico: vacuna Sinopharm
Uno de los estudios con mayor cantidad de voluntarios en el Perú
Vacuna contra el SARS-CoV-2
La vacuna contra el SARS-CoV-2 (VeroCell) es una vacuna inactivada contra la enfermedad del COVID-19 que estimula el sistema inmunológico del cuerpo sin riesgo de causar la enfermedad. Una vez que el virus inactivado se presenta ante el sistema inmunológico del cuerpo, estimula la producción de anticuerpos y prepara al cuerpo para responder ante una infección por SARS-CoV-2 vivo.
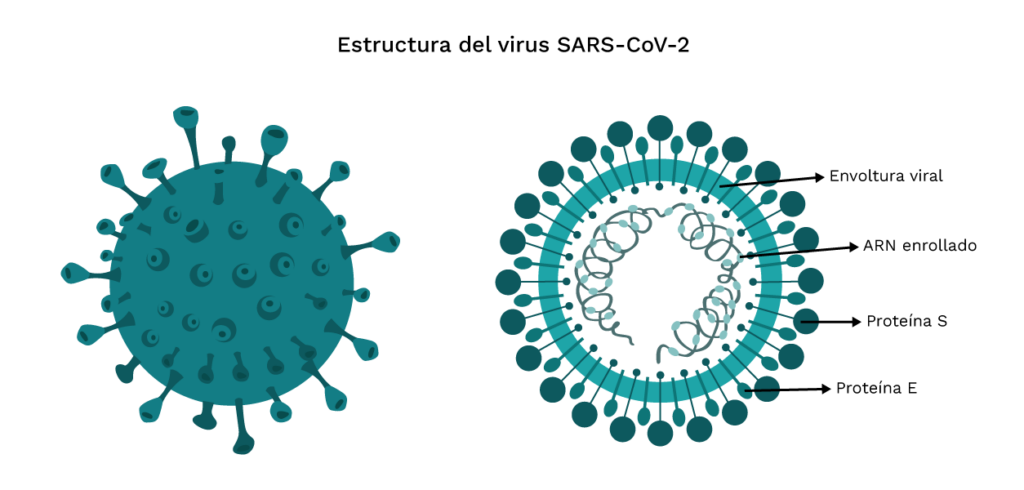
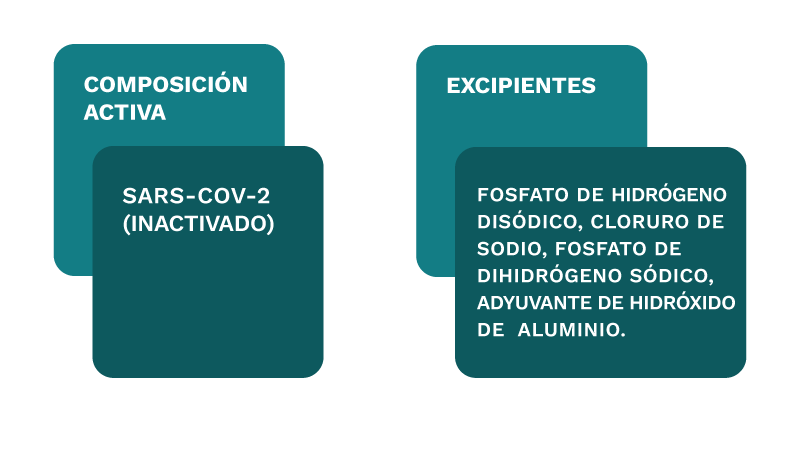
Esta vacuna está formulada con la cepa del SARS-CoV-2 que es inoculada en las células vero. El virus es cultivado, cosechado, inactivado con βpropiolactona, concentrado y purificado. Luego es absorbida con adyuvante de aluminio para formar la vacuna líquida.
Organización y desarrollo del estudio clínico de la Vacuna contra el SARS-CoV-2 en Perú
Los objetivos de este estudio fueron evaluar dos vacunas en aspectos de seguridad (para evaluar si no causan eventos adversos) y eficacia (para evaluar si protegen de la infección).

El inicio del estudio en el Centro de Investigación de la UPCH fue el 09 de septiembre de 2020 y en el Centro de Investigación de la UNMSM fue el 29 de septiembre del mismo año.
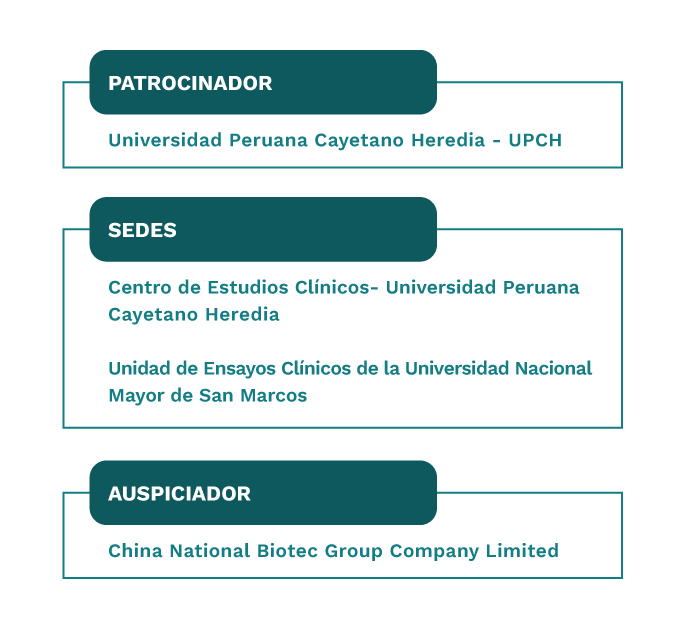
La Universidad Peruana Cayetano Heredia asumió el rol de patrocinador en este ensayo clínico que se llevó a cabo en dos centros de investigación:
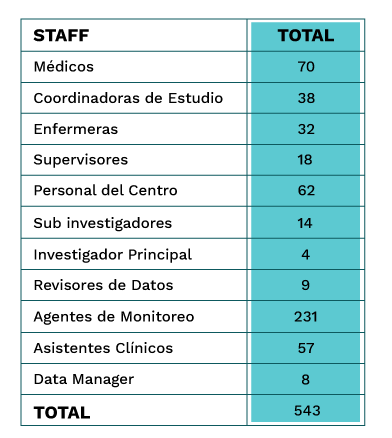
Entre ambos centros, en total, trabajaron más de 500 personas relacionadas a los sectores de salud, investigación, educación, tecnología médica, gestión de datos, administración en salud y tecnología de la información.
Mantener la cadena de frío fue uno de los pilares fundamentales en el sistema de aseguramiento de la calidad del producto en investigación.
El estudio clínico de Sinopharm contó con equipos de refrigeración de grado farmacéutico y con un sistema de monitoreo de condiciones de temperatura constante. Esto garantizó las condiciones de estabilidad y conservación del producto en investigación. Asimismo, el apoyo logístico de CENARES-MINSA fue muy importante en las diferentes etapas del estudio (Fase ciega y Fase etiqueta abierta).

Diseño del estudio
El estudio consistió en la evaluación de dos tipos de vacuna inactiva contra el SARS-CoV-2. Se inyectó a los voluntarios la vacuna con variante Wuhan (200 WU/dosis) o variante Beijing (4 μg/dosis) o placebo. Debido a los objetivos del estudio, este fue de carácter doble ciego.
En estudios de doble ciego, la asignación a uno u otro grupo se hace al azar. Asimismo, por el tipo de estudio, el participante ni el equipo del estudio saben si está recibiendo la vacuna de prueba o el placebo, de esta manera todos los participantes son manejados con objetividad.
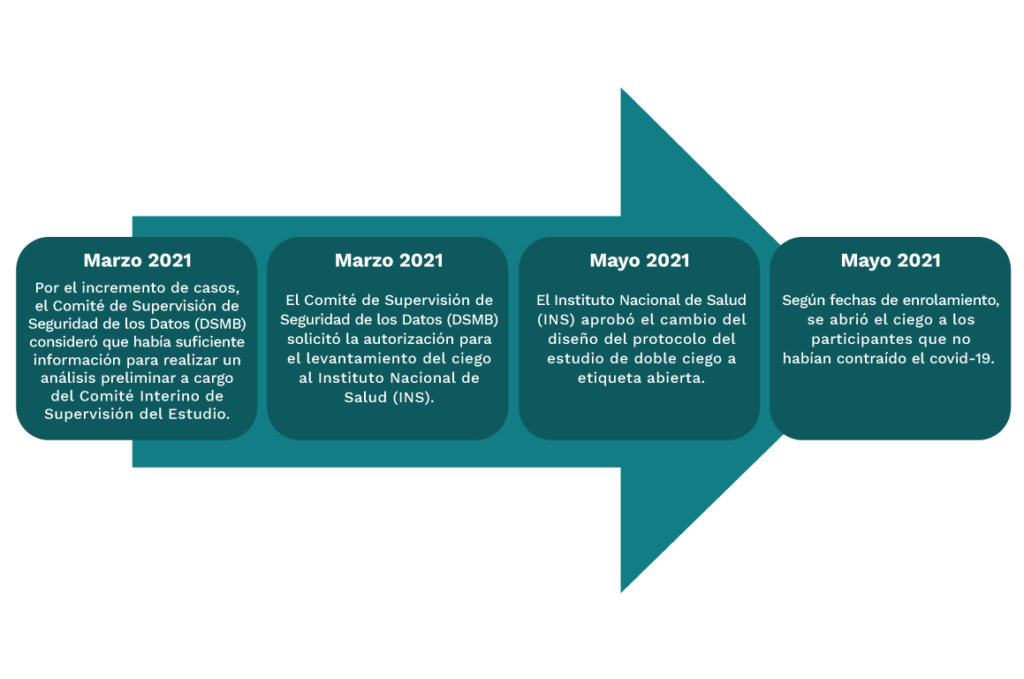
Asimismo, a medida que el Estado desarrolló el Plan Nacional de Vacunación se empezó a abrir el ciego a las personas que tenían una fecha de vacunación cercana.
Los voluntarios que recibieron placebo o la vacuna en investigación Wuhan fueron inoculados con la vacuna Sinopharm Beijing como parte del acceso de vacunación contemplado en la enmienda 4.0 del protocolo del estudio aprobada por el INS el 3 de mayo de 2021.
El 13 de mayo de 2021, la Dirección General de Medicamentos, Insumos y Drogas autorizó la importación del producto en investigación y productos complementarios del estudio clínico (Fase etiqueta abierta). Así es como el 18 de mayo del mismo año, llegó al Perú el producto en investigación (fase etiqueta abierta) proveniente de China.
Voluntarios
Enrolamiento
El enrolamiento a voluntarios empezó en septiembre de 2020 y terminó el 19 de diciembre del mismo año. Se buscaron personas sanas, mayores de 18 años, sin manifestaciones de la infección por el SARS-CoV-2 y que no se encuentren embarazadas o dando de lactar al momento del reclutamiento.
Para ser aceptados en el estudio, los participantes tuvieron que firmar voluntariamente un consentimiento informado que afirmaba que estos podían cumplir con los requisitos del protocolo del estudio clínico. Asimismo, se informaba las situaciones de retiro anticipado: 1) si el participante ya no quería ser parte del estudio clínico; 2) si el participante era inoculado con otra vacuna de investigación clínica durante el periodo de estudio; 3) si el participante se apegaba al Plan Nacional de Vacunación contra la COVID-19.
Muestra
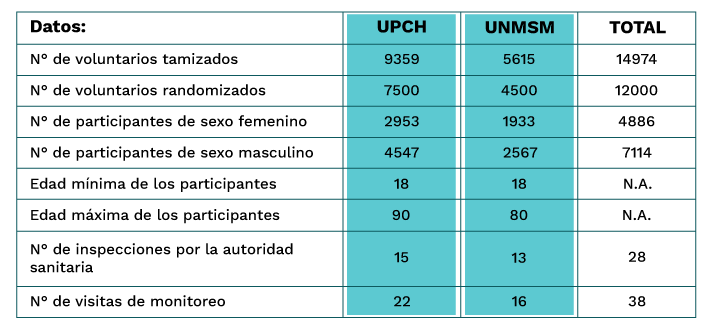
En total, la muestra resultó de 12 mil participantes asignados aleatoriamente en tres grupos: 1) los que recibieron la vacuna Sinopharm Beijing (BIBP); 2) los que recibieron la vacuna Sinopharm Wuhan (WIBP); 3) los que recibieron placebo. Cabe mencionar que alrededor del 10% de los participantes fueron personas mayores de 60 años, lo cual es importante para un estudio de eficacia y seguridad en personas de la tercera edad.
En el siguiente cuadro se puede observar el detalle:
DUARI
duari.ensayosclinicos@oficinas-upch.pe
